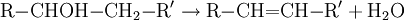Otthoni tanulásra alkalmas online mindenes füzet
Tanulj tinó, ökör lesz belőled!
Etilén
Az etilén (IUPAC neve etén) egy C2H4 összegképletű szerves vegyület. Az alkének legegyszerűbb képviselője, telítetlenszénhidrogén. Színtelen, kormozó lánggal égő gáz. Molekulája apoláris, vízben rosszul, szerves oldószerekben (például toluolban,éterben) jól oldódik. Jelentősége nagy, etilénből gyártják a polietilént, ami fontos műanyag. Növényi hormon, gyorsítja a gyümölcsökérését és szabályozza a növények virágzását.
Fizikai tulajdonságai
Színtelen, nem mérgező, édeskés szagú gáz. Levegőnél kisebb sűrűségű. Vízben rosszul oldódik (apoláris). Molekulái között gyenge másodrendű kölcsönhatások lépnek fel, ezért olvadás- (-169 °C) és forráspontja (-104 °C) is alacsony.
Kémiai tulajdonságai
Az etilén az alkének közé tartozik, az alkének az alkánokkal ellentétben nagyon reakcióképesek. A nagy reakciókészség a telítetlen kötéssel magyarázható.
Égése
Az etilén meggyújtásakor világító, kormozó lánggal ég. A kormozó láng arra utal, hogy az etilén égése magas szén- és alacsony hidrogéntartalma miatt nem tökéletes. A világító láng azzal magyarázható, hogy az el nem égett koromszemcsék izzanak.
Az égés reakcióegyenlete (tökéletes égés esetén):
Az etilén levegővel robbanóelegyet alkot.
Addíciós reakciói
Az etilén kétszeres kötése igen hajlamos addíciós reakciókra. Addíciós reakcióban két vagy több molekula egyesül, melléktermék nem képződik. Az etilén könnyen addícionál halogéneket. A reakció brómmal a következő egyenlet szerint játszódik le:
A folyamatban 1,2-dibrómetán képződik. Hidrogén-halogenidekkel is addíciós reakcióba lép, hidrogén-klorid addíciójakor például klór-etán keletkezik:
Katalizátor (például finom eloszlású platina) jelenlétében hidrogénnel addíciós reakcióba vihető, telíthető. Az etilén telítésekor etán keletkezik.
A hidrogén-halogenidekkel analóg módon addícionál kénsavat is, etil-hidrogénszulfát (savanyú kénsavészter) keletkezése közben.
Az etilén vízaddíciója kénsav jelenlétében megy végbe. Az etilén először kénsavat addicionál, majd a keletkező etil-hidrogénszulfát hidrolízise során etanol képződik:
Szén-monoxid és hidrogén addíciója etilénre propionaldehidet eredményez.
Oxidációs reakciók
Az etilén enyhe oxidációjakor (H2O2 vagy lúgos közegben KMnO4 hatására) egy epoxid (etilén-oxid) jön létre átmeneti termékként, majd az etilén-oxid etilénglikollá hidrolizál. Az epoxidok háromtagú oxigéntartalmú gyűrűt tartalmazó heterociklusos vegyületek. Az etilén-oxid szerkezete az éterekre hasonlít (gyűrűs éternek tekinthető). Nagyon reakcióképes, könnyen bomlik.
Az etilén erőteljes oxidációjakor (KMnO4 hatására kénsavas közegben) a telítetlen kötés felhasad és két molekula hangyasav képződik.
Szintén az etilén oxidációs reakciói közé tartozik az ozonidos lebontása is. Az ozonidos lebontás ózongáz hatására játszódik le. A folyamat lánchasadással jár. A lebontás során gyűrűs termék keletkezik. A képződő ozonid robbanékony vegyület. Az ozonidot többféleképpen el lehet bontani, hidrolízise során például aldehid keletkezik.
Etilénből és ecetsavból oxigén és katalizátor jelenlétében vinil-acetát keletkezik. Ez egy több lépésben lejátszódó oxidációs reakció.
Polimerizáció (poliaddíció)
A poliaddíció a polimerizáció egyik fajtája. Több etilénmolekula kapcsolódik össze makromolekulává, polimerré. A poliaddíció során az addícióhoz hasonlóan nem keletkezik melléktermék. Az etilén polimerizációja katalizátor hatására megy végbe. A polimerizáció során polietilén képződik.
Előállítása
Az etilén ipari méretekben kőolaj vagy földgáz krakkolásával állítható elő. A krakkgázok jelentős mennyiségű etilént tartalmaznak. Laboratóriumban előállítható etanolból kénsavval vízelvonással vagy 1,2-dibrómetánból (vagy 1,2-diklóretánból) eliminációval. Az elimináció cink hatására játszódik le a dibrómetán (vagy diklóretán) alkoholos oldatának melegítésekor.
Alkének
Az alkének olyan telítetlen szénhidrogének, amelyekben egy vagy több szén-szén kétszeres kötés található. Régies olefin nevük onnan származik, hogy a kisebb rendszámú alkének halogének addíciójával olajszerű termékké alakultak. A legegyszerűbb alkén az etén. A molekulában lévő szénatomok közti kettős kötések száma szerint léteznek mono-, di-, triolefinek. Az egy kettős kötést tartalmazó alkének homológ sort alkotnak. Általános képletük: CnH2n. Léteznek gyűrűs olefinek is, ezek neve cikloalkén vagy cikloolefin.
Csoportosításuk
Az alapján, hogy az alkénekben hány kettős kötést tartalmaznak, a monoolefin, diolefin, triolefin, poliolefin, stb. csoportokra oszthatók. A kettő vagy több kettős kötést tartalmazó alkének neve: polién vagy poliolefin. A diolefinek, a két kettős kötést tartalmazó alkének (diolefinek, diének)az alapján csoportosíthatók, hogy a kettős kötések egymáshoz képest hogyan helyezkednek el. A kumulált diénekben a két kettős kötés közvetlenül egymás mellett található a konjugált diénekben a kettős kötések között egy, az izolált diénekben kettő vagy kettőnél több egyszeres kötés található.
Izoméria
Az alkánokhoz hasonlóan az alkéneknél is fellép a szerkezeti vagy konstitúciós izoméria. Több szerkezeti izomerjük lehetséges, mint az alkánoknak, mert olyan izomerek is léteznek, amelyekben a kettős kötés helyében van különbség. Például háromféle négy szénatomos monoolefin létezik, a 2-metilpropén, a but-1-én (vagy más néven 1-butén) és a but-2-én (vagy 2-butén).
Geometriai izoméria
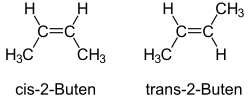
Az alkénekben nem lehetséges rotáció (elfordulás) a kettős kötés körül. Ezért az etilén 1,2-diszubsztituált származékainak (olyan származékainak, amelyben a mindkét szénatomon helyettesítve van 1-1 hidrogén valamilyen csoporttal) tekinthető alkéneknél fellép a geometriai vagy cisz-transz izoméria. A cisz-transz izoméria a sztereoizoméria egyik fajtája, azaz az izomerek között csak az atomok térbeli elhelyezkedésében van különbség. A 2-buténnek például két sztereoizomerje létezik, ezek neve cisz-2-butén és transz-2-butén. Az előbbiben a két metilcsoport a kettős kötés azonos, az utóbbiban az ellentétes oldalán található. A kétféle izomert szokás Z, illetve E betűkkel is jelölni. A cisz-transz izomerek közül mindig a cisz-változatnak nagyobb az energiatartalma, a transz-izomer a stabilabb.
Fizikai tulajdonságaik
A monoolefinek homológ sorának első három tagja szobahőmérsékleten gáz halmazállapotú, az 5 és a 15 közti szénatomszámúak folyadékok, az ennél több szénatomot tartalmazókszilárdak. A konjugált diének közül a butadién gáz (forráspontja -4,4 °C), az izoprén és a gyűrűs ciklopentadién cseppfolyós halmazállapotú. Apoláris vegyületek, vízben alig, szerves oldószerekben jól oldódnak.
Kémiai tulajdonságaik
Addíciós reakciók
A nyílt láncú alkének hidrogénnel alkánokká, a gyűrűs cikloolefinek cikloalkánokká telíthetők. A hidrogénaddíció nikkel vagy platinakatalizátor jelenlétben játszódik le. A nyílt láncú olefinek telítésének reakcióegyenlete:
Az alkének halogénekkel nagyon könnyen addíciós reakcióba lépnek. A reakciókészség Cl < Br < I irányban nő. Az addíciót indifferens, a reakció szempontjából közömbös oldószerben végzik. A brómaddíció egyrészt az alkének kétszeres kötésének kimutatására használható, az addíció során a bróm színe eltűnik. Másrészt átmenetileg megvédhető vele a kettős kötés, mert a két brómatom cink segítségével könnyen eltávolítható (elimináció). A brómaddíció egyenlete:
Az alkének könnyen addícionálnak hidrogén-halogenideket is. Az addíció során alkil-halogenidek keletkeznek. A hidrogén-halogenidek addíciójára általában érvényes a Markovnyikov-szabály: az alkén úgy addícionálja a hidrogén-halogenidet, hogy a hidrogénje a kettős kötésnek ahhoz a szénatomjához kötődik, amelyhez eleve is több hidrogén kapcsolódott, a halogénatom pedig a másik szénatomhoz kapcsolódik. Például a propilén hidrogén-jodid addíciója például 2-jód-propánhoz vezet.
A hidrogén-bromid addíciója oxidálószerek jelenlétében azonban nem a Markovnyikov-szabály szerint történik. (A hidrogén arra a szénatomra lép be, ahol eredetileg kevesebb hidrogén volt). A reakciókészség hidrogén-halogenidek esetén HCl < HBr < HI irányban nő.
Az alkének kénsavaddíciója is a hidrogén-halogenid addícióhoz hasonló módon játszódik le. A reakcióban alkilhidrogénszulfátok, savanyú kénsavészter jellegű vegyületek képződnek. A Markovnyikov-szabály itt is érvényes, például propilénből izoporpil-hidrogénszulfát keletkezik. A reakció gyakorlati jelentősége nagy, mert a keletkezett észterek alkoholokkáhidrolizálhatók, és így alkénekből alkoholok állíthatók elő.
Az alkének hipoklórossav-addíciójánál a Markovnyikov-szabály úgy érvényesül, hogy a halogén kapcsolódik ahhoz a szénatomhoz, amelyen több hidrogén van. A keletkező klórhidrinek gyakorlati jelentősége nagy.
Polimerizáció
A polimerizáció vagy poliaddíció az alkének fontos és nagy gyakorlati jelentőségű reakciója. Polimerizáció során nagyon sok alkénmolekula kapcsolódik össze óriásmolekulává. A polimerizáció is addíciós folyamatnak tekinthető. A polimerizáció savakkal vagy peroxidokkal katalizálható, a katalizátor a reakció mechanizmusát is befolyásolja. Az alkének és az alkénszármazékok polimerizációs termékei fontos műanyagok, etilén polimerizációjakor polietilén, propilénből polipropilén, sztirolból polisztirol, vinil-kloridból PVC, izoprénből kaucsuk,kloroprénből klórkaucsuk keletkezik. A polimerizáció általános reakcióegyenlete:
Oxidációs reakciók
Az alkének telítetlen kötése érzékeny oxidációval szemben. Enyhébb oxidáció során (például hidrogén-peroxiddal oxidálva vagy kálium-permanganát hatására lúgos közegben) az alkének először epoxidokká oxidálódnak. Az epoxidok háromtagú gyűrűs heterociklusos vegyületek, a gyűrűjükben oxigénatom található. Gyűrűs étereknek tekinthetők, igen reakcióképes vegyületek. Az oxidációkor keletkező epoxidok víz hatására könnyen kétértékű alkoholokká hidrolizálnak. A legegyszerűbb alkén, az etilén oxidációjakor például először etilén-oxidkeletkezik, majd ez hidrolizál etilénglikollá.
Az alkének kálium-permanganáttal lúgos közegben végzett oxidációja a telítetlen kötés kimutatására használható, mert a reakció a permanganát elszíntelenedésével jár (Baeyer-próba).
Az alkének erőtejes oxidációjakor kettős kötésük felhasad, az eredetileg a kétszeres kötést alkotó szénatomok karboxilcsoporttá oxidálódnak. A reakcióban karbonsavak keletkeznek, 1-buténből egy molekula hangyasav és egy molekula propionsav, 2-buténből két molekula ecetsav.
Oxidációs reakció az ozonidos lebontás is. Az alkének ózon hatására gyűrűs ozonidok keletkeznek, ez a reakció is a kétszeres kötés elszakadásával jár. A keletkező ozonidok instabilak, robbanékonyak, víz hatására oxovegyületekre (aldehidekre és/vagy ketonokra) és hidrogén-peroxidra hidrolizálnak. Az ozonidos lebontás a kettős kötés helyének meghatározására használható. Izobutilén (2-metilpropén) lebontásakor például aceton és formaldehid keletkezik.
Szubsztitúciós reakciók
Az alkének szubsztitúciós reakciói kevésbé jelentősek, mint az addíciós reakciók, egyedül a halogénezés jelentős. Az allilhelyzetű szénatomhoz (A kétszeres kötéshez közvetlenül kapcsolódó telített szénatomhoz) kapcsolódó hidrogénatomok bizonyos módszerekkel halogénre cserélhetők. Az allilhelyzetű brómozás N-bróm-szukcinimiddel végezhető el, az alkén kloroformos oldatának forralásával (Ziegler-féle brómozás). A propén 500 °C-on klórozható az allilhelyzetű szénatomján, allilklorid keletkezik. Ez egy gyökös mechanizmus szerint lejátszódó szubsztitúciós reakció.
Előállításuk
Az alkének telített vegyületekből eliminációval állíthatók elő. Az elimináció során a telített vegyület két szomszédos atomjáról egy-egy atom vagy atomcsoport távozik.
Alkének nyerhetők telített szénhidrogénekből dehidrogénezéssel. Iparilag a fontosabb szénhidrogéneket a kőolaj krakkoló lepárlásával gyártják. A krakkolást magas hőmérsékleten (800-900 °C) végzik, a krakkolás dehidrogéneződéssel jár. A keletkező gázelegy (krakkgázok) fontos alkéneket, etilént, propilént és butiléneket tartalmaz.
A vicinális dihalogénezett szénhidrogénekből (olyan szénhidrogénekből, amelynek két szomszédos szénatomjához is halogénatom kapcsolódik) fémek, például cink vagy réz segítségével a két halogénatom eltávolítható. A halogénatomok helyén kettős kötés jön létre. Az eliminációt nátrium-jodid katalizálja. (A nátrium-jodid hatására a vegyületből dijódszármazék keletkezik, majd ez lép reakcióba a fémmel.) A brómatomok eliminációja cinkkel a következő egyenlet szerint játszódik le:
Alkoholokból vízelvonással (például kénsav hatására) szintén alkének keletkeznek.
Halogénezett szénhidrogénekből tömény lúg hatására lejátszódó elimináció során szintén kétszeres kötést tartalmazó vegyületek képződnek.
Honlapkészítés ingyen:
Ez a weblapszerkesztő alkalmas
ingyen weboldal,
ingyen honlap készítés...
Mai: 3
Tegnapi: 8
Heti: 30
Havi: 108
Össz.: 27 114
Látogatottság növelés
Otthoni tanulásra alkalmas online mindenes füzet - © 2008 - 2025 - hazi.hupont.hu
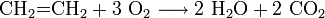


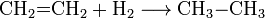





![\mathrm{n \ CH_2{=}CH_2 \longrightarrow [-CH_2{-}CH_2-]_n}](http://upload.wikimedia.org/math/2/4/8/248c0fc8ec7ad5f37b144fcd7b18a9da.png)




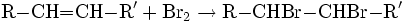



![\mathrm{n \ CH_2{=}CH{-}R \rightarrow [-CH_2{-}CHR-]_n}](http://upload.wikimedia.org/math/b/8/4/b8470039bdbd4b0411c14907728e0389.png)